Ավագ դպրոց-վարժարան 9-րդ դաս.շարունակելու ենք ուսումնասիրել կարևորագույն ոչ մետաղներից.
- «Ազոտ, ազոտի շրջապտույտը բնության մեջ, ազոտական թթուն և նրա աղերը, ազոտական պարարտանյութեր»
Ազոտ N2
Ազոտն անգույն, անհոտ, անհամ, ջրում քիչ լուծվող գազ է: Այն ամենատարածված քիմիական տարրերից է և բնության մեջ հանդիպում էինչպես ազատ վիճակում, այնպես էլ միացությունների ձևով: Ազոտը օդի հիմնական բաղադրիչն է և կազմում է նրա 75,6%-ը` ըստ զանգվածի: Երկրակեղևում ազոտը գտնվում է միացությունների ձևով,առավել տարածված են նատրիումական և կալիումական բորակները: Ազոտ են պարունակում նաև քարածուխը, նավթը և կենդանի օրգանիզմները: Բույսերը ազոտը վերցնում են հողից, իսկ կենդանիները այն ստանում են բույսերից:
Ազոտի մոլեկուլը երկատոմ է: Ազոտը հիմնականում կիրառվում է ամոնիակ ստանալու համար , որը ելանյութ է ազոտական թթվի,ազոտական պարարատանյութերի, ներկերի , դեղանյութերի, պայթուցիկ նյութերի արտադրության մեջ: Գազային ազոտն օգտագործվում է որպես իներտ միջավայր հեղուկ վառելանյութի մզման, սրվակները հեղուկ դեղանյութերով լցնելու համար: Հեղուկ ազոտն չափազանց սառն է -196 օC: Սննդարդյունաբերության մեջ այն օգտագործվում են սննդամթերքը սառեցնելու և երկար պահպանելու համար, բժշկության մեջ` մարդու սերմնաբջիջներն ու ձվաբջիջները երկար պահպանելու, ինչպես նաև մի շարք հիվանդություններ բուժելու համար:
Ազոտի շրջապտույտը բնության մեջ
Բնության մեջ ազոտի շրջապտույտը Երկրի վրա կյանքի գոյության անհրաժեշտ պայման է:Ազոտի հիմնական մասը ազատ վիճակում գտնվում է մթնոլորտում, իսկ ավելի փոքր մասը`միացությունների ձևով` հողում, բուսական և կենդանական օրգանիզմներում: Բնության մեջ ազոտի շրջապտույտը բարդ գործընթաց է: Հողում ապրող որոշ բակտերիաներ կլանում են օդի ազոտը և վերածում ամոնիակի և հանքային աղերի:Կան բակտերիաներ, որոնք մահացած բույսերի ու կենդանիների օրգանական ազոտը փոխարկում են ամոնիակի ու նիտրատների; Օդի ազոտը կապելու հիմնական ճանապարհը դա օքսիդացումն է` ամպրոպների ժամանակ: Դրա հետևանքով առաջանում է ազոտի մոնօքսիդ NO, որն օքսիդանում է մինչև ազոտի Երկօքսիդ NO2 : Վերջինս անձրև տեսքով թափվում է երկրի վրա` ոպես ազոտական թթու, և հողի հանքային աղերի առաջացնում է նիտրատներ: Ֆրանսիացի ագրոքիմիկոս Ժ. Բուսենգոն 1830-40 ական թվականներին բացահայտել է, որ հողում ազոտային միացությունների բացակայության դեպքում բույսերը չեն կարող աճել ու զարգանալ:
Ազոտական թթուն
Ազոտական թթուն շատ ուժեղ միահիմն թթու է ջրում գրեթե լրիվ դիսոցվում է: Ազոտական թթուն, ինչպես մյուս թթուները փոխազդում է մյուս թթուների նման ջրածին չի անջատում, այլ անջատում է ազոտի օքսիդներ,ամոնիակ կամ ազատ ազոտ:
Մետաղների հետ ազոտական թթվի փոխազդեցությունը կախված է թթվի կոնցետրացիայից ու փոխազդող մետաղի ակտիվությունից: ազոտական թթվի մոլեկուլի անկայունությունը կարևոր առանձնահատկություն է: Ջրային լուծույթում այդ թթուն ավելի կայուն է,մինչդեռ 98% զանգվածային բաժնով ազոտական թթուն անկայուն է և լույսի ազդեցությամբ քայքայվում է:
Ազոտական պարարտանյութեր
Դրանք անօրգանական և օրգանական ազոտ պարունակող միացություններ են, որոնց հողի մեջ են մտցնում բերքառատության համար: Ազտային պարարտանյութերը հիմնականում ստանում են սինթետիկ ամոնիակից; Ազոտի միացությունների պատճառով հաճախ սահմանափակում է մշակաբույսերի աճը և դրա համար էլ ազոտային պարարտանյութերն ունեն մեծ դրական ազդեցություն:
- «Ֆոսֆոր, ֆոսֆորական թթուն և իր աղերը, ֆոսֆորական պարարտանյութեր»
Ֆոսֆոր, քիմիական տարր է որի նշանն է P և ատոմային թիվը՝ 15։ Ֆոսֆորը (P) հայտնաբերել է Հենինգ Բրանդը 1669-ին։ Բնության մեջ գտնվում է միայն միացությունների ձևով։ Հանդես է գալիս մի քանի ալոտրոպ ձևափոխություններով։ Ոչ մետաղ է։
Սպիտակ Ֆոսֆորը (P4) փափուկ, ջրում չլուծվող, անգույն, խիստ թունավոր նյութ է։ Լավ լուծվում է CS2-ում, tհալ=44°С, tեռ=281°С։ Շնորհիվ լուսարձակելու հատկության, ստացել է իր անունը։ Թույլ տաքացնելիս օդում ինքնաբոցավառվում է։
Կարմիր ֆոսֆորը ամորֆ պոլիմերային միացություն է, քիմիապես պասիվ է սպիտակ ֆոսֆորից, թունավոր չէ։ Սև ֆոսֆորը մետաղական փայլով պոլիմերային նյութ է, թունավոր չէ, ունի կիսահաղորդիչ հատկություններ։
Քիմիական հատկությունները
Ստանում են կալցիումի ֆոսֆատի, SiO2 և C-ի խառնուրդն էլեկտրական վառարանում առանց օդի մուտքի մոտ 1000°С տաքացնելով․ 2Ca3(PO 4) 2+6SiO2+10C→6CaSiO3+10CO↑+P4↑
Ստացված գազային P4-ը բաց թողնելով ջրի մեջ` վեր են ածում պինդ վիճակի:
Փոխազդեցությունը ոչ մետաղների հետ
4P + 5O2 → 2P2O5 (կամ P2O3) 4P + 3O2 → 2P2O3 2P + 3Cl2 → 2PCl3 (կամ PCl5)
Փոխազդեցությունը ակտիվ մետաղների հետ
3Li+P=Li3P 3Ca+2P=Ca3P2
Ինչպես նաև օքսիդիչ թթուների և ալկալիների հետ․
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO↑ 4Р + 3KOH + 3Н2О → РН3↑ + 3KН2РО2
Ֆոսֆիդները մետաղների և ֆոսֆորի միացություններ են,որտեղ ֆոսֆորի օքսիդացման աստիճանը -3 է: Նրանք աղատիպ պինդ միացություններ են,հեշտությամբ քայքայվում են ջրով կամ թթուներով` առաջացնելով ֆոսֆին. Mg3P2+6H2O=3Mg(OH)2+2PH3↑ Li3P+3HCl=3LiCl+PH3↑ Ֆոսֆինը (PH3) սխտորի հոտով,թունավոր գազ է:Այն ունի ուժեղ վերականգնիչ և թույլ հիմնային հատկություններ.

 (ֆոսֆոնիումի քլորիդ)
(ֆոսֆոնիումի քլորիդ)
Ֆոսֆորի (III)օքսիդը (P2O3) սպիտակ բյուրեղային նյութ է:Գոլորշի վիճակում կազմված է P4O6 մոլեկուլներից tհալ =24°С tեռ=175°С:
Ստանում են ֆոսֆորը թթվածնի պակասորդում այրելիս
4P+3O2=2P2O3 Ջրի հետ փոխազդելիս կարող է առաջացնել երկու թթու` HPO2-մտաֆոսֆորային թթու և H3PO3-օրթոսֆոսֆորային թթու,որոնք թույլ թթուներ են:P2O3-ը ուժեղ վերականգնիչ է. P2O3+2Cl2+5H2O=2H3PO4+4HCl:
Ֆոսֆորը բնության մեջ
Դեպի թթվածինը ունեցած իր բարձր ակտիվության հետևանքով, ֆոսֆորը բնության մեջ ազատ վիճակում չի հանդիպում։ Նա գտնվում է բուսահողում և հանքերում միայն ֆոսֆորական թթվի աղերի ձևով, առավելապես ֆոսֆորաթթվական կալցիումի կամ կալցիումիֆոսֆատ՝ աղի ձևով։ Այն գլխավոր հանքերը, որոնց բաղադրության մեջ մտնում է այդ աղը, ապատիտը ու ֆոսֆորիտն են։
Բույսերը չեն կարող հաջողությամբ զարգանալ և պտղաբերել, եթե հողի մեջ անբավարար են ջրի մեջ լուծվող ֆոսֆորային միացությունները։
Միացությունների ձևով ֆոսֆորը մտնում է մարդու և կենդանիների ոսկրային, մկանային և նյարդային հյուսվածքներ կազմության մեջ։ Նրանց համար ֆոսֆորի աղբյուր է ծառայում բուսական սնունդը։ Սննդի մեջ ֆոսֆորի միացությունների պակասության դեպքում մարդու և կենդանիների մեջ առաջանում են լուրջ հիվանդություններ։
- «Ածխածին, ածխածնի բնական մոդիֆիկացիաները՝ տարաձևությունները՝ ալմաստ, գրաֆիտ, ածխածնի օքսիդները՝ շմոլագազ և ածխաթթու գազ, ածխաթթուն և նրա աղերը:
Ածխածին , քիմիական նշանը՝ C, ատոմային թիվն է 6, ատոմային զանգվածը՝ 12.011։ Բնական ածխածինը բաղկացած է երկու ստաբիլ նուկլիդներից՝ 12C (զանգվածի 98.892%-ը) և 13C (զանգվածի 1.108%-ը)։ Նուկլիդների բնական խառնուրդում շատ չնչին քանակությամբ միշտ առկա է լինում 14C ռադիոակտիվ նուկլիդը (b– ճառագայթ, կիսատրոհման պարբերությունը՝ 5730 տարի)։ Այն անընդհատ առաջանում է մթնոլորտի ստորին շերտերում՝ ազոտի 14N իզոտոպի նեյտրոնների տիեզերական ճառագայթման շնորհիվ։ 147N + 10n = 166C + 11H
Ածխածինը տեղակայված է Մենդելեևի պարբերական համակարգի երկրորդ պարբերության IVA խմբում: Ատոմի հիմնական վիճակի արտաքին էլեկտրոնային մակերևույթի դասավորվածությունն է 2s2p2: Օքսիդացման կարևորագույն աստիճաններն են +2, +4, -4, վալենտականությունները՝ IV և II։ Ածխածնի նեյտրալ ատոմի շառավիղը 0.077 նմ է։ C4+ իոնի շառավիղը` 0.029 նմ (կոորդինացիոն թիվը 4), 0.030 նմ (կոորդինացիոն թիվը 6)։
Պատմական տեղեկություններ
Ածխածինը հայտնի է հեռու անցյալից։ Փայտածուխն օգտագործվել է հանքաքարերից մետաղները վերականգնելու համար, իսկ ալմաստը՝ ինչպես թանկարժեք քար։ 1789 թ. ֆրանսիացի քիմիկոս Ա. Լ. Լավուազիեն հետևություն արեց ածխածնիտարրային հատկությունների մասին։ Արհեստական ալմաստները առաջին անգամ ստացվել են 1953 թ. շվեդ հետազոտողների կողմից, սակայն արդյունքները նրանք չհասցրեցին հրապարակել։ Արհեստական ալմաստ ստացան «Ջեներալ էլեկտրիկ» ընկերության աշխատակիցները 1954 թ. դեկտեմբերին և 1955-ի սկզբին հրապարակեցին։
Բնության մեջ տարածվածությունը
Ածխածինը զբաղեցնում է երկրակեղևի զանգվածի 0.48%-ը։ Կուտակվում է կենսոլորտում. կենդանական նյութերում պարունակվում է 18% ածխածին, բնափայտում՝ 50%, տորֆում՝ 62%, բնական այրվող գազերում՝ 75%, այրվող թերթաքարերում՝ 78%, քարածուխում և գորշածուխում՝ 80%, նավթում՝ 85%, անտրացիտում (լավատեսակ քարածուխ)՝ 96%։ Երկրակեղևի ածխածնի նշանակալի մասը կենտրոնացված է կրաքարերում և դոլոմիտներում։ +4 օքսիդացման աստիճանի ածխածինը մտնում է կարբոնատային ապարների և հանքանյութերի (կավիճ, կիր, մարմար, դոլոմիտներ) բաղադրության մեջ։ Ածխաթթու գազը՝ CO2, մթնոլորտի հիմնական բաղադրիչներից է (զանգվածի 0.046%-ը)։ Ածխաթթու գազը լուծված վիճակում միշտ առկա է գետերի, լճերի և ծովերի ջրում։ Աստղերի, մոլորակների և երկնաքարերի մթնոլորտում հայտնաբերված են ածխածին պարունակող նյութեր։
Ստացումը
Հնում ածուխը ստանում էին բնափայտի թերի այրման միջոցով։ 19-րդ դարում մետաղագործության մեջ փայտածուխը փոխարինեցին քարածուխով (կոքսով)։ Ներկայումս արդյունաբերության մեջ ածուխ ստանում են բնական գազի՝ մեթանի (CH4) կրեկինգով (նավթաթորմամբ).
CH4 = C + 2H2
Բժշկական նպատակների համար ածուխը պատրաստում են կոկոսի կեղևի այրմամբ։ Իսկ լաբորատոր անհրաժեշտությունների համար չայրվող խառնուրդներից զերծ ածուխ ստանում են շաքարի թերի այրումից։
- «Սիլիցիում, սիլիկաթթուն և իր աղերը, լուծվող ապակի, սիլիկատային արտադրություն՝ խեցեղենի, ցեմենտի և ապակու արտադրություն»:
Սիլիցիումը քիմիական տարր է, որի նշանն է՝ Si, իսկ կարգաթիվը՝14: Սիլիցիումի ագրեգատային վիճակը՝ պինդ:
Թթվածնից հետո սիլիցիումը ամենատարածված տարրն է, և կազմում է երկրակեղևի կշռի 25 տոկոսը: Անկենդան աշխարհում խաղում է այնպիսի դեր, ինչպիսին ածխածինը՝ կենդանի: Ի տարբերություն ածխածնի՝ սիլիցիումը բնության մեջ ազատ վիճակում չի հանդիպում: Նրա բազմաթիվ միացությունները կազմում են լեռնատեսակների և հանքերի հսկայական մեծամասնությունը,օր.՝ գրանիտներ,գնեյսներ,բազալտներ,կվարց,դաշտաշպատներ,փայլար և այլն: Ավազը և կավը՝ որոնք կազմում են հողի հանքային մասը,նույնպես սիլիցիումի միացություններ են:
Հատկությունները
Բյուրեղային սիլիցիումը որոշ նմանությունունի մետաղների հետ, նա ունի փայլ ևէլէկտրահաղորդականություն, սակայնթթուների հետ այն չի փոխազդում։Մանրացված սիլիցիումը զգալի չափովտաքացնելիս` օդի մեջ կարելի է բռնկել,գոյացնելով սիլիցիումի դիօքսիդ՝ Si+O2=SiO2:
Սիլիցիումն օգտագործվում է համաձուլվածքների արտադրության մեջ: Չորս տոկոսսիլիցիում պարունակող պողպատը օգտագործվում է էլեկտրական տրանսֆորմատորներպատրաստելու համար: Ավելի մեծ քանակով սիլիցում՝ 15 տոկոս և ավելի, պարունակողպողպատը թթվակայուն է և կիրառվում է քիմիական ապարատներ պատրաստելու համար:
Սիլիցիումի գերմաքուր կտոր
սիլիցիումի միացությունը ածխածնի հետ՝ սիլիցիումի կարբիդը (SiC), կոչվում էկարբորունդ։ Այն իր կարծրությամբ մոտենում է ալմաստին:
Սիլիցիում ստանում են էլեկտրական վարառաններում. բարձր ջերմաստիճանային պայմաններում սիլիցիումի դիօքսիդը՝ ավազը, ածուխին միացնելով. SiO2+2C=Si+2CO:
Առաջադրանք. գրե՛ք երեք բան,ինչ սովորեցիք իմ նյութից:
Ապակի
Գոյություն ունեն բնական և արհեստական ապակիներ:
Բնական ապակիները՝ պեռլիտները, վանակատները (օբսիդիան) և այլն, հրաբուխներիգործունեության արգասիք են և կոչվում են նաև հրաբխային ապակիներ:
Արհեստական ապակին՝ ամորֆը, փխրուն, թափանցիկ, քիմիապես կայուն նյութ է: Այնստանում են հատուկ վառարաններում՝ սոդայի (Na2CO3), կավճի (CaCO3), սիլիկահողի(SiO2) խառնուրդը միահալելով: Արդյունքում առաջանում են նատրիումի և կալցիումիսիլիկատներ, որոնք, սիլիկահողի հետ միաձուլվելով, վերածվում են հեղուկապակեզանգվածի, իսկ հետագա սառեցմամբ` պինդ ապակու: Այսպիսի ապակին կոչվումէ սիլիկատային: Սոդան պոտաշով (K2CO3) փոխարինելու դեպքում ստանում ենդժվարահալ ապակի: Կավիճը՝ կապարի (II) օքսիդով (PbO), իսկ սոդան պոտաշովփոխարինելու դեպքում ստանում են բյուրեղապակի: Սկզբնական խառնուրդին տարբերմետաղների օքսիդներ ավելացնելիս սիլիկատային ապակին ստանում է տարբեր գույներ,օրինակ՝ քրոմի (III) օքսիդից՝ կանաչ, կոբալտի (II) օքսիդից՝ կապույտ, մանգանի (IV)օքսիդից՝ կարմրամանուշակագույն և այլն: Եթե ապակին պարունակում է մոտ 99%սիլիկահող, ապա կոչվում է քվարցային ապակի:
Տաքացնելիս ապակին աստիճանաբար փափկում է և անցնում հեղուկ վիճակի: Հակառակընույնպես տեղի է ունենում աստիճանաբար՝ սառեցմանը զուգընթաց ապակե զանգվածըպնդանում է: Ապակու այս հատկության վրա է հիմնված դրանից տարբեր իրերիձևավորումը, որն իրականացվում է տարբեր եղանակներով: Ապակու ձգումը մեքենաներովկիրառվում է թերթային ապակու, խողովակների, ապակեձողիկների, ապակեթելերիարտադրության, գլոցումը՝ շինարարական, նախշազարդ թիթեղապակիների համար:Փչումը կիրառվում է նեղ բերանով ամանեղեն, մամլումը՝ հաստ պատերով իրերպատրաստելու համար:
Ըստ կիրառության և հատկությունների՝ առանձնացվում են ապակու մի շարք տեսակներ՝շինարարական, տեխնիկական, օպտիկական, էլեկտրամեկուսիչ և էլեկտրավակուումային,լուսատեխնիկական, լուծվող, տարայի, տեսակային և գեղարվեստական, ապակեթել և այլն:
Սիլիցիումի երկօքսիդ
Սիլիցիումի երկօքսիդ, սիլիկահող, Si02, սիլիցիումի և թթվածնի միացությունըսիլիկաթթվի անհիդրիդն է։ Անգույն, դժվարահալ, պինդ նյութ է, հալվում է +1728 °C-ում,չի լուծվում ջրում և թթուներում։ Լուծվում է ֆտորաջրածնական թթվում, շատ դանդաղ՝նաև ալկալիներում։ Խառնուրդներ պարունակող սիլիցիումի երկօքսիդը գունավորված է։Առաջացնում է պոլիմորֆային ձևափոխություններ՝ քվարց, տրիդիմիտ, կրիստոբալիտ,կոեսիտ, ստիշովիտ, կիտիտ, մանրաթելային սիլիկա հող։ Հալված սիլիցիումի երկօքսիդըպնդանում է՝ առաջացնելով ամորֆ ձևափոխություն՝ քվարցե ապակի։ Սիլիցիումիերրկօքսիդը անօրգանական պոլիմեր է՝ բաղկացած է թթվածնի ընդհանուր ատոմներովիրար միացած [Si04]4 քառանիստերից (ստիշովիտը՝ [SiOe]8՜ օկտաէդրներից)։ Բնությանմեջ հանդիպում է քվարց, տրիդիմիտ և կրիստոբալիտ, նաև ջուր պարունակող օպալկիզելգուր միներալների ձևով և կազմում է երկրակեղևի զանգվածի 12%։ Սիլիցիումիերկօքսիդը օգտագործվում է սիլիկատների (ապակի, խեցեղեն, հղկափոշի, բետոն, աղյուս)արտադրության մեջ և ռադիոտեխնիկայում։
Անհատական- հետազոտական աշխատանքների թեմաները.
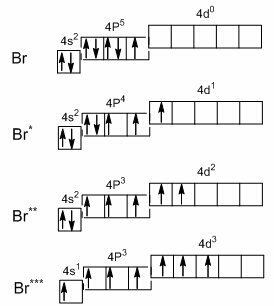
Կենսական տարրերը այն քիմիական տարրի ատոմներն են, որոնք առաջացնում են կենդանի օրգանիզմի կենսագործունեությունը ապահովող նյութերը։ Մանկոկենսական տարրերն են՝ ածխածին` C, ջրածին` H, թթվածին՝ O, ազոտ՝ N, ֆոսֆոր՝ P, ծծումբ՝ S: Միկրոտարրեն են՝ կալիում՝ K, կալցիում՝ Ca, մագնեզիում՝ Mg, նատրիում՝ Nа, երկաթ՝ Fe, ֆտոր՝ F, բրոմ՝ Br, յոդ` I, քլոր՝ Cl, մանգան՝ Mn։ Ուլտրատարրեր են՝ ոսկի` Au, արծաթ՝ Ag և այլն։
- Օրգանական նյութեր՝ սպիտակուցներ, ածխաջրեր, ճարպեր, նուկլեինաթթուներ
Անհնար է գերագնահատել սպիտակուցների, ճարպերի և ածխաջրերի դերը: Չէ՞ որ մեր օրգանիզմը դրանցից է բաղկացած: Ինչպես սնվել՝ պահպանելով այդ կարևոր և փխրուն հավասարակշռությունը:
Սպիտակուցները, ճարպերը և ածխաջրերը մեր օգանիզմում
Մարդու օրգանզիմը բաղկացած է 19.6% սպիտակուցներից, 14.7% ճարպերից, 1% ածխաջրերից, 4.9% հանքային նյութերից: Մնացած 59.8% ջուր է: Մեր օրգանիզմի նորմալ կենսագործունեությունն անմիջականորեն կապված է կարևորագույն սննդարար նյութերի հարաբերակցությունից. օրվա սննդակարգում սպիտակուցների, ճարպերի և ածխաջրատների ներկայությունը պետք է լինի 1:3:5:
Սպիտակուցների կարևորությունն ու դերը
Սպիտակուցները օրգանիզմի հիմնական շինարարական նյութն են, ինչպես նաև հորմոնների, ֆերմենտների և հակամարմինների հիմքը: Այսպիսով, առանց դրանց մասնակցության, անհնարին են աճը, բազմացումը, մարսողությունը և իմունային պաշտպանությունը:
Սպիտակուցները պատասխանատու են գլխուղեղի կեղևում արգելակման և գրգռման համար: Հեմոգլոբին սպիտակուցը տեղափոխում է թթվածին (տրանսպորտային դեր), ԴՆԹ և ՌՆԹ ապահովում են սպիտակուցի՝ ժառանգական տեղեկատվությունը փոխանցելու հատկությունը, լիզոցիմն ապահովում է հակամիկրոբային պաշտպանություն, իսկ տեսողական նյարդի կազմի մեջ մտնող սպիտակուցը ապահովում է լույսի ընկալումն աչքի ցանցաթաղանթի օգնությամբ:
Բացի դրանից, սպիտակուցը պարունակում է անփոխարինելի ամինաթթուներ, որոնցից կախված է իր կենսաբանական արժեքը: Հայտնի 80 սպիտակուցներից միայն 8 են անփոխարինելի, և եթե այդ բոլոր ութն էլ պարունակվում են սպիտակուցի մոլեկուլի մեջ, այդպիսի սպիտակուցը կոչվում է լիարժեք, ըստ ծագման՝ կենդանական, այն պարունակվում է մսի, ձկան, ձվի, կաթի մեջ:
Բուսական սպիտակուցները քիչ լիարժեք են, ավելի դժվար են մարսվում, քանի որ բջջանքից թաղանթ ունեն, որը խանգարում է մարսողական ֆերմենտների աշխատանքին: Մյուս կողմից, բուսական սպիտակուցը հզոր հակակարծրային էֆեկտ ունի:
Սննդի մեջ կենդանական սպիտակուցների մասը պետք է կազմի 55%-ից ոչ պակաս:
Սպիտակուցային անբավարարությունն արտահայտվում է մարմնի քաշի նվազմամբ, մաշկի չորությամբ, աղե-ստամոքսային համակարգի սեկրետոր ֆունկցիայի թուլացմամբ: Նաև տուժում են սեռական գեղձերի, մակերիկամների, վահանաձև գեղձի աշխատանքը, խանգարվում են արյունաստեղծ պրոցեսները, թուլանում է իմունիտետը և հիշողությունը: Երեխաների մոտ խանգարվում է աճը՝ ոսկրաստեղծման վատացման հաշվին:
Մյուս կողմից, սպիտակուցների ավելցուկը նույնպես վնաս է՝ այն բերում է հոդերի հիվանդության և միզաքարային հիվանդության զարգացմանը:
Ճարպերի ֆունկցիան և օգուտը
Ճարպը առաջին հերթին էներգիայի աղբյուր է, ուստի դրա նյութափոխանակությունը շատ կարևոր է:
Ճարպերը բաղկացած են հագեցած և չհագեցած ճարպաթթուներից: Հագեցածները կոչվում են դժվարահալ, քիչ են մարսվում: Չհագեցածները, հակառակը, հեշտությամբ հալչում և մարսվում են:
Հագեցած ճարպաթթուները՝ ստեարինային, պալմինտային, կապրոնային, և այլն, հեշտությամբ սինթեզվում են մարդու օրգանիզմում, ցածր բիոլոգիական արժեք ունեն, դժվար են հալչում, բացասաբար են ազդում ճարպային փոխանակության վրա, նպաստում են խոլեսթերինի կուտակմանը և բերում են աթերոսկլերոզի զարգացմանը: Նման ճարպեր կան ոչխարի մսի, խոզի մսի և բուսական յուղերի մեջ:
Չհագեցած ճարպերը՝ օլեինային, լինոլային, լինոլենային, առախիդոնային ճարպերը պատկանում են կարևորագույն նյութերի շարքին, բարձրացնում են անոթային պատի առաձգականությունը, կանխում են թրոմբի առաջացումը, կարգավորում են ճարպային փոխանակությունը, պարունակվում են արևաձաղկի և եգիպտացորենի յուղերի, նաև ձկան յուղի մեջ:
Ճարպերի գերօգտագործումը բերում է խոլեսթերինի ավելցուկին, աթերոսկլերոզի զարգացմանը, ճարպային փոխանակության վատացմանը, ավելորդ քաշի կուտակմանը: Ճարպերի պակասը կարող է առաջացնել լյարդի և երիկամների ֆունկցիայի խանգարում, ջրի կուտակում օրգանիզմում, դերմատոզների զարգացում:
Սննդակարգում բուսական և կենդանական ճարպերի հարաբերակցությունը պետք է լինի 30% և 70%, սակայն տարիքի հետ նախապատվությունը պետք է տալ բուսական ճարպերին:
Ածխաջրերի հավասարակշռության մասին
Ածխաջրերը էներգիայի հիմնական աղբյուրն են՝ ապահովելով մարդու օրգանիզմի էներգետիկ պահանջի 58%-ը: Բուսական մթերքները պարունակում են ածխաջրերը մոնո-, դի- և պոլիսախարիդների տեսքով:
— Մոնոսախարիդներ (գլյուկոզա, ֆրուկտոզա, գալակտոզա) պարզ ածխաջրերն են, հեշտությամբ լուծվում են ջրում, կարևոր են լյարդում գլիկոգենի ստեղծման, ուղեղի և մկանների սնուցման, արյան մեջ շաքարի նորմալ մակարդակի պահպանման համար:
— Դիսախարիդներ (սախարոզա, լակտոզա, մալտոզա) քաղցր են, օրգանզիմում բաժանվում են մոնոսախարիդների երկու մոլեկուլների:
— Պոլիսախարիդներ (օսլա, բջջանք, գլիկոգեն, բարդ ածխաջրեր) քաղցր չեն, ջրում չեն լուծվում: Հետզհետե քայքայվելով մոնոսախարիդների՝ այդ ածխաջրերն ապահովում են օրգանիզմի հագեցվածությունն էներգիայով, և, առաջացնելով հագեցման զգացում, գործնականում չեն բարձրացնում արյան մեջ շաքարի մակարդակը:
Կարևոր է, որ օրգանիզմում ածխաջրերի պակասի դեպքում էներգիան առաջանում է ճարպերի և նույնիսկ սպիտակուցների պաշարից: Սա է աստիճանաբար և անվտանգ նիհարելու սկզբունքը: Իսկ ածխաջրերի ավելցուկը բերում է դրանց ճարպերի վերածվելուն, խոլեսթերինի գերարտադրությանը, ճարպակալմանը, աթերոսկլերոզին, հրահրում է շաքարային դիաբետի առաջացումը:
Այսպիսով, նորմալ ինքնազգացողության, կենսուրախության, դրական տրամադրության համար մեզ անհրաժեշտ է ոչ միայն կալորիաների բավարար և օպտիմալ քանակություն, այլև հիմնական սննդարար նյութերի ճիշտ հարաբերակցություն: Ամեն ինչ լավ է չափի մեջ, և սննդարար նյութերի պակասը լավ չէ: Օրնինակ՝ ավելորդ քաշից ազատվել և չկորցնել առողջությունը կարելի է միայն բոլոր անհրաժեշտ սննդարար նյութերի հավասարակշիռ ընդունման դեպքում:
1970-ական թվականներին աշխարհի տարբեր երկրներում հանելուկային թունավորումների բռնկումներ գրանցվեցին: Ինչպես պարզվեց՝ պատճառը նիտրատներն էին, որոնք մեծ քանակություններով օգտագործվել էին, որպես պարարտանյութ: Ահա թե ինչու նիտրատներ պարունակող սննդամթերքներով զանգվածային թունավորումներն անվանվեցին նիտրատային աղետ:
Նախկինում, երբ որպես պարարտանյութ օգտագործում էին գոմաղբը, նիտրատների հիմնախնդիր չի առաջացել։ Գոմաղբն ու օրգանական բնույթի մյուս պարարտանյութերը դանդաղ քայքայվում ե՝ն ապահովելով ազոտի մուտքը դեպի բույսեր, և հողում նիտրատների ավելցուկ չի առաջանում։ Մինչդեռ միլիոնավոր տոննաներով արտադրվող հանքային պարարտանյութերի չափից ավելի մեծ քանակության դեպքում բույսերը ցողուններում, տերևներում և պտուղներում նիտրատներ են կուտակում։ Բացի այ՝դ ազոտի միացությունների ավելցուկը հողի մակերեսային շերտից ջրով անցնում է խորքային ջրերի մեջ, այնուհետ՝և խմելու ջրի հետ թափանցում մեր բնակարանները։ Ջրի կամ սննդամթերքիհետ մարդու օրգանիզմ թափանցելո՝վ նիտրատները փոխարկվում են նիտրատների, որոնք ավելի վտանգավոր միացություններր են, քանի որ փոխազդում են արյան հեմոգլոբինի հետ։ Որպես արդյուն՝ք արյան կարմիր բջիջներ՝ը էրիտրոցիտները, կորզվում են թոքերից դեպի հյուսվածքները թթվածին տեղափոխելու ունակությունը, և օրգանիզմում թթվածնային քաղց է սկսվում։ Ներկայումս գիտնականները նիտրատային աղետի դեմ պայքարելու արդյունավետ միջոցներ են փնտրում։ Մասնավորապե՝ս խորհուրդ է տրվում սահմանափակել հանքային (հատկապե՝ս բարդ) պարարտանյութերի արտադրությունն ու կտրուկ ընդլայնել էկոլոգիապես մաքու՝ր ավանդական պարարտանյութերի կիռարումը։
- «Ազոտային և ֆոսֆորային պարարտանյութեր»
Ազոտական պարարտանյութերը անօրգանական և օրգանական ազոտ պարունակող միացություններ են, որոնց հողի մեջ են մտցնում բերքառատության համար։ Հանքային ազոտային պարարտանյութերի թվին են պատկանում ամիդային, ամոնիակային և նիտրատային պարարտանյութերը։ Ազոտային պարարտանյութերը հիմնականում ստանում են սինթետիկ ամոնիակից։ Ազոտի միացությունների պատճառով հաճախ սահմանափակում է մշակաբույսերի աճը և դրա համար էլ ազոտային պարարտանյութերն ունեն մեծ դրական ազդեցություն։ Բոլոր տեսակի ազոտային պարարտանյութերից ամենաշատը տուժում են հողի միկրոօրգանիզմները։ Առաջին շաբաթում պարարտանյութի 70 տոկոսը մտցնելուց հետո առաջանում են բակտերիաներ և սնկեր ու միայն նրանց մահվանից հետո պարարտանյութերի կազմում եղած ազոտը կարող է օգտագործվել։ Բույսերի բնականոն աճի ու զարգացման համար մոտ 22 քիմիական տարր է անհրաժեշտ։ Առանձնապես կարևոր է կալիում, ազոտ, ֆոսֆոր, ածխածին,թթվածին և ջրածին տարրերի նշանակությունը։ Պակաս քանակությունը։ Պակաս քանակություններով, բայ՝ց պարտադիր, պահանջում են կալցիում, մագնեզիում, երկաթ և այլ տարրեր։ Իսկ որոշ տարրեր (պղինձ, կոբալ՝տ Co, ցինկ և այլն) չնչին քանակություններով են անհրաժեշտ, սակայն հողում այդ տարրերի իսպառ բացակայությունը բույսերի համար կործանարար է։ Բույսերն իրենց անհրաժեշտ տարրերը կլանում են հողից, իոնների ձևո՝վ (NH4)+,(NO3), K+, (H2PO4) –, Fe3+, Cu2+ և այլն։ Երեք կարևոր տար՝ր ազոտ, ֆոսֆոր և կալիումը, անհրաժեշտ են բույսերին մեծ քանակություններով, ուստիև այդ տարրերը պարունակողպարարտանյութերն ստանում են արդյունաբերական մասշտաբներով։
- «Թանկարժեք քարեր»`

Թանկարժեք քարեր
Զմրուխտը հիասքանչ գեղեցկություն ունեցող թանկարժեք քար է: Խորը և հագեցած գույնն է , որ այս քարին հաղորդում է յուրահատկություն և բացառիկություն: Նա ունի բարձր որակ և գնահատվում է ավելի թանկ, քան ալմաստը,ադամանդե մատանիներն ու ականջօղերը միասին վերցրած: Զմրուխտ անունը ծագել է հունական “smaragdos” բառից, որը նշանակում է կանաչ քար: Անթիվ անհամար պատմություններ կան կապված այս քարի հետ: Դեռևս ինկերի և այցտեկների ժամանակաշրջանում զմրուխտը համարվել է սուրբ քար: Հարավային Ամերիկայում են գտնվել ու գտնվում ամենալավ զմրուխտները: Սակայն հնագետները զմրուխտների մեծ պաշար են գտել Կարմիր ծովում, որը հայտնի է եղել նաև եգիպտական փարավոններին դեռևս մեր դարաշրջանից առաջ 3000-1500 թ: Զմրուխտի գույնը խորհրդանշում է կյանքի գույնը: Այն Հին Հռոմում գեղեցկության և սիրո աստվածուհու խորհրդանիշն է եղել: Եվ մեր օրերում էլ այս գույնը ունի յուրահատուկ նշանակություն: Կանաչ գույնը մահմեդականները համարում են սուրբ, իսկ բոլոր արաբական երկրների լիգաները ունեն կանաչ գույնի ազգային դրոշներ: Բարձր հեղինակություն ունի կանաչ գույնը նաև կաթոլիկ եկեղեցիներում: Կանաչ գույնը ուրախացնում է աչքը, հաղորդում է թարմություն և խորհրդանշում է կյանքը: Զմրուխտը զարմացնում է մեզ իր ունիկալ և փայլուն գունային համադրությամբ, այն իր տեսակի մեջ եզակի քար է: Շնորհիվ իր կարծրության ինքն իրեն պաշտպանում է տարատեսակ քերծվածքներից և վնասվածքներից, բայց միևնույն ժամանակ օժտված է փխրունությամբ, ինչն էլ դարձնում է նրան զգայուն կտրվածքի ժամանակ: Նրա թանկարժեքությունը պահանջում է մեծ պատասխանատվություն կտրվածք անողից:
Սուտակը (ռուբին) հանքաքար է, որն ունի կարմիր գույն: Նրա գունային համադրությունը տատանվում է խորը վարդագույնից մինչև մուգ մանուշակագույն և խիտ կարմիրից մինչև բաց մանուշակագույն: Ռուբին անունը ծագել է լատիներեն «ռուբելլա» բառից, որը թարգմանաբար նշանակում է կարմիր: Կարմիր գույն քարին հաղորդում է նրա մեջ պարունակվող քրոմի խառնուրդը: Իր ամրությամբ ռուբինը զբաղեցնում է 2-րդ տեղը ալմաստից հետո: Իր արտաքին տեսքով այս քարը նման է շպինելին, տարբերվում է միայն բյուրեղների կառուցվածքով: Ռուբինը թանկարժեք քար է: Նրա բյուրեղիկները օժտված են շքեղ փայլով: Թանկարժեք քարերի մեջ այդպիսի շքեղ փայլով օժտված է միայն ալմաստը: Այն բացառապես մոգական քար է: Հայտնվել է Եվրոպայում 1800թ-ին, իսկ 1835թ-ին հայտնաբերվեց այս քարի արհեստական ստանալու եղանակը: Կան փաստեր այն մասին, որ դեռևս հին ժամանակներում այս քարը օգտագործել են Հնդկաստանում, Եգիպտոսում, Հունաստանում, Հին Հռոմում` արքայական տոհմերը և հոգևորականները` որպես թալիսման: Լինելով մոգական քար` այն մեծ դեր է ունեցել բժշկության մեջ: Այս քարը հաղորդում է աշխուժություն, ուրախություն, համարձակություն, արթնացնում է քնած կրքերը: Կարգավորում է քունը, ախորժակը, վերադարձնում է կորցրած էներգիան, կարգավորում է ճնշումը: Բոլոր ժամանակներում բուժական նպատակներով կիրառել են ոչ միայն այս քարը, այլ նաև այն ջուրը, որի մեջ պահել են այն:
Շափյուղա (սապֆիր) անվանումը ծագել է հունական “sappheiros”բառից, որը թարգմանաբար նշանակում է կապույտ քար: Կապույտ գույն քարին հաղորդում են նրա մեջ պարունակվող տիտանի և երկաթի խառնուրդները: Շափյուղան նույնպես թանկարժեք քար է: Բացի սովորական կապույտ շափյուղայից բնության մեջ հանդիպում են նաև նարնջագույն, վարդանարնջագույն, վարդագույն, դեղին և անգույն շափյուղաներ: Այս քարին անվանում են ֆանտաստիկ քար: Շափյուղա կա երկրագնդի բոլոր մասերում, բացի Անտարկտիդայից: Այս քարի գլխավոր մատակարար երկրներն են Թայլանդը, Շրի Լանկան, Հնդկաստանը, Ամերիկան, Ավստրալիան, Մադագասկարը, Ֆրանսիան, Լեհաստանը, Ռուսաստանը: Ավելի գեղեցիկ շափյուղաներ հայտնաբերվել են դեռևս 19-րդ դարում Հնդկաստանում: Այդ քարերը հագեցած էին կապտամանուշակագույն երանգով, որի շնորհիվ էլ ստացան «մետաքսե» անվանումը: Մինչ այսօր այդ շափյուղաները համարվում են որակի էտանոլ: Այս քարի յուրահատկությունները հայտնի են եղել մարդկությանը դեռ վաղուց: Շափյուղան օգնում է նվաճել սեր և պահպանում է կրողին նախանձ մարդկանցից: Այն բուժում է երիկամները, միզապարկը, նպաստում է երիկամներից քարերի հեռացմանը, բուժում է շաքարային դիաբետը, վերականգնում է ինսուլտից հետո և ազատում է քրոնիկ սթրեսներից ու դեպրեսիաներից, օգնում է ազատվել մի շարք մաշկային հիվանդություններից, հեռացնում է պիգմենտային բծերը և նպաստում է վերքերի շուտ ապաքինմանը: Ինքնին այս քարի գույնը բուժիչ, թերապևտիկ ազդեցություն է թողնում բոլոր տեսակի հիվանդությունների ժամանակ:
Ֆիզիկական հատկություններն ու ստացումը Ածխածնի (II) օքսիդը ( շմոլագազ) օդից փոքր-ինչ թեթև գազ է, գույն, հոտ ու համ չունի, ջրում գրեթե չի լուծվում և ջրի հետ չի փոխազդում: Անտարբեր (աղ չառաջացնող) օքսիդ է: Խիստ թունավոր է, անգամ փոքր քանակությամբ այդ գազը ներշնչելն էլ ոչ հազվադեպ դժբախտ պատահարների պատճառ է դառնում: Ժողովրդին հայտնի է իր ռուսերեն անվանմամբ՝ «ուգար»:
Արդյունաբերության մեջ մեծ քանակությամբ ածխածնի (II) օքսիդ է ստացվում ածխի, ինչպես նաև այլ՝ պինդ, հեղուկ ու գազային վառելանյութերի թերայրման հետևանքով: Մեծ քանակությամբ ածխածնի (II) օքսիդ են պարունակում ավտոմեքենաների ներքին այրման շարժիչներից արտանետվող գազերը: Շմոլագազով թունավորման՝ շմոլքի առաջին նշաններն գլխապտույտը, սրտխառնոցը, ապա՝ գիտակցության կորուստը:
Ածխածնի (II) օքսիդից թունավորումից խուսափելու նպատակով անհրաժեշտ է. ա) հետևել վառարանում վառելիքի բնականոն այրմանը, բ) կանխել ածխածնի (II) օքսիդի ներթափանցումը բնակարան, գ) թունավորման դեպքում տուժածին անմիջապես մաքուր օդ դուրս բերել, ուշագնացության դեպքում՝ երեսին սառը ջուր ցանել ու արհեստական շնչառություն ապահովել, դ) լուրջ թունավորման դեպքում առանց հապաղելու բժշկի դիմել:
Հաճախ որպես գլոբալ տաքացման հոմանիշ օգտագործվում է «ջերմոցային էֆեկտ» բառակապակցությունը, սակայն այդ հասկացությունների միջև կա փոքր տարբերություն: Ջերմոցային արդյունքը Երկրի և Համաշխարհային օվկիանոսի մթնոլորտի մակերեսային շերտի միջին տարեկան ջերմաստիճանի աճն է (ածխածին, մեթան, գոլորշի և այլն): Այդ գազերը կատարում են ջերմոցի թաղանթի դեր, ազատ թույլ տալով արևի ճառագայթներին հասնել Երկրի մակերեսին, սակայն թույլ չեն տալիս դրանց անցնել մոլորակի մթնոլորտի միջով: Գլոբալ տաքացումն իր հերթին հանգեցնում է Երկրի մթնոլորտի և Համաշխարհային օվկիանոսի մթնոլորտի մակերեսային շերտի միջին տարեկան ջերմաստիճանի աստիճնական բարձրացմանը, արևային և հրաբխային ակտիվության բարձրացմանը և այլն:
- «Խեցեղենի, ցեմենտի և ապակու արտադրություն»
Ցեմենտի արդյունաբերություն
Ցեմենտի արդյունաբերությունը, հանդիսանալով շինանյութերի արդյունաբերության առաջատար ճյուղերից մեկը, ներառում է տարատեսակ ցեմենտների արտադրություն. պորտլանդցեմենտ, խարամային պորտլանդցեմենտ, պուզոլանային պորտլանդցեմենտ, հատուկ ցեմենտներ (դեկորատիվ, տամպոնաժային, կավահողային, սուլաֆատակայուն, հիդրոտեխնիկական կառույցների ցեմենտ, արագ ամրացող ցեմենտ և այլն): Համարվելով հիմնական կապակցող նյութ, ցեմենտը լայնորեն կիրառվում է ժողովրդական տնտեսությունում, հիմնականում բետոնի, երկաթբետոնի, շինարարական լուծույթների արտադրությունում, ինչպես նաև ասբոցեմենտի, նավթարդյունահանման և արդյունաբերության այլ ոլորտներում:
Ցեմենտի արտադրության չոր եղանակ
Պայթեցումից հետո փխրեցված հումքը հանքավայրից ավտոտրանսպորտով տեղափոխվում է հումքի նախապատրաստման արտադրամաս, որտեղ կատարվում է նախնական դոզավորում, մանրացում, համասեռացում և պահեստավորում: Մանրացված հումքը տեղափոխվում է չափավորման հանգույց և բաղադրամասերի հետ միաժամանակ, դոզատորների միջոցով, չափավորվում և ուղարկվում է փակ ցիկլով աշխատող հումքաղացներ: Հումքաղացներում հումքը միաժամանակ չորացվում և մանրացվում է, որից հետո ուղարկվում է միջինացման բարձր գործակից ունեցող խառնման աշտարակներ:
Ցեմենտի արտադրության չոր եղանակ
Կիզման համար անհրաժեշտ քիմական բաղադրակազմով ստացված հումքալյուրը տեղափոխվում է ծախսման աշտարակներ, որտեղ տեղի է ունենում լրացուցիչ միջինացում: Կլինկերի կիզումը կատարվում է 4,5×80 մ պտտվող վառարանում, որը հագեցած է ցիկլոնային ջերմափոխանակիչներով և ռեակտոր-դեկարբոնիզատորով: Պատրաստի կլինկերը սառնարանում հովացվելուց հետո տեղափոխվում կլինկերի աշտարակներ: Կլինկերը և հավելանյութերը դոզատորների ճշգրիտ աշխատանքի միջոցով չափավորվում և տեղափոխվում են ցեմենտի աղացներ, որտեղ փակ ցիկլով աշխատող կենտրոնախույս սեպարատորների օգնությամբ տեղի է ունենում ցեմենտի աղացում՝ ապահովելով արտադրանքի բարձր որակ: Ցեմենտը սպառողներին առաքվում է ինչպես ավտոմոբիլային այնպես էլ:
Խեցեղենի արտադրությունը Հայաստանում
Հայերի խեցեղեն արտադրանքը զարդարել է եկեղեցիներ, մզկիթներ, պալատներ, արտահանվել Եվրոպա:
Հայաստանում մինչև 1950-ական թվականները շուկայի մատակարարը ժողովրդական բրուտագործ վարպետներն էին. կրկնում էին դարերի ընթացքում մշակված խեցեղեն իրերի ձևերը: Հետագայում Երևանում կառուցվեցին հախճապակու, Արտաշատում՝ բրուտախեցեգործական, ճենապակու գործարաններ, Երևանի գեղարվեստաթատերական ինստիտուտում (այժմ` Երևանի գեղարվեստի ակադեմիա) բացվեց դեկորատիվ-կիրառական արվեստի բաժին:
- Հնադարյան ապակեգործության սկիզբը մթա III հազարամյակ. Կապնված է Նեղոս, Տիգրիս, Եփրատ գետահովիտների և Կրետե կղզու քաղաքակրթության հետ
- Մթա 1350 թվականին ապակեգործության կենտրոնը դարձել է հին Եգիպտոսի մայրաքաղաք Թեբեն: Այդ ժամանքկաշրջանից մեզ են հասել ապակե անոթներ և ուլունքներ, որոնք կրում էին արքայական տան ներկայացուցիչները։ Գունավոր ապակիներից սովորեցին պատրաստել թանկարժեք քարերի նմանվածքներ, որոնք գնահատվում էին բնական թանկարժեք քարերին հավասար։
- Անտոնիո Ների (1576-1614). Ապակեգործության զարգացման մեջ կարևոր դեր է խաղացել, ապակու արտադրության հարցերին ուղված առաջին տպագիր աշխատությունը։ Դա <<Ապակեգործության արվեստի մասին>> գիրքն է, որը առաջին անգամ տպագրվել է Ֆլորենցիայում 1612 թվականաին
- Մ․Վ․ Լոմոնոսով (1711-1765) 1753 թվականին հիմնեց ապակու գործարան Ստեղծեց ռուսական խճանկարային արտադրությունը Ստեղծում էր զանազան օպտիկական սարքեր <<Ապակու օգտի մասին գրերում>> գիտնականը խոսում է զարդերի, սպասքի, շինարարության, օպտիկայի, աստղագիտության և էլեկրականութայն ոլորտներում նրա կիրառման մասին
- XIX դարից սկսած ապակու արտադրությունը դուրս եկավ նոր՝ արդյունաբերական մակարդակ 1910 թվականին ֆրասիացիգիտնական Էդուարդ Բենեդիկտուսը հայտնագործեց հատուկ՝ գնդադիմացկուն ապակու արտադրության եղանակակ։ Այդպիսի ապակին հայտնի է, որպես լամինացված և անվանում է <<տրիպլեկս>>։
- Գոյություն ունի ապակու չորս տեսակ Հեղուկ (նատրիումի և կալիումի սիլիկատների կոնցենտրացված լուծույթներ) Քվարցային Տիպիկ Օրգանական
- Սովորական ապակու արտադրության հումք հիմնականում հանդիսանում են։ Մաքուր Քվարցային ավազ,սոդա և կրաքար։ Այդ նյութերը խառնում են և տաքացնում (1500С)։ Na2CO3 + SiO2=Na2SiO3+ CO2 CaCO3+ SiO2= CaSiO3+ CO2
- Որպեսզի ապակին չլուծվի ջրիմ մեջ,նրա մեջ ավելացնում են կրաքար CaCO3: Na2CO3 + CaCO3 +6 SiO2=2CO2 + Na2O • CaO • 6SiO2 Պատուհանային ապակու բաղադրությունը Na2O • CaO • 6SiO2 (Na2O – 12,9%, CaO – 11,6% , SiO2 – 75,5%),
- Տիպիկ ապակիները բաժանվում են պատուհանային օպտիկական բիոապակի լաբարատոր
- Բնական ապակի՝պերլիտ, օբսիսիդիան։Սկզբնական շրջանում ստացվում էին ոչ թափանցիկ ապակիներ, որոնցով նմանագործում էին արհեստական քարերը (մալաքիտ, փիրուզ և այլն)։
- Հավելումների ավելացման ուրիշ դեպքերում, փոխբում են ապակու հատկությունները։ Օրինակ՝․ Կադմիումի օքսիդ պարունակող ապակին պահում է նեյտրոններին Կապարի (II) օքսիդը- ռենտգենյան ճառագայթները Վանադիումի օքսիդները– ուլտրամանուշակա Գեղադիտակում օգտագործված են տարբեր գույների ապակիներ։ Գունավոր ապակիների ստացման համար ապակու մեջ ավելացնում են հավելումներ։ Կոբալտի օքսիդ-կապույտ Քրոմի (III) օքսիդ – զմրուխտ կանաչ Մանգանի (II) օքսիդ – մանուշակագույն Երկաթի (II) միացություններ – կանաչ
- Դարերի ընթացքում ապակեգործությունը եղել է արվեստ և ծանր աշխատանք։Տաղանդավոր վարպետները հավաքում էին ապակու ձուլման գաղտնիքները և բացահայտում ձուլման նոր եղանակներ։ .
- Ձուլման գործնթացը բաժանվում է փուլերի I փուլ- սիլիակատագոյացում II փուլ- ապակեգոյացում III փուլ- լուսավորում IV փուլ- համասեռացում V փուլ- սառեցում
- Սիլիկատագոյացում Սիլիկատագոյացման փուլում տեղի է ունենում ջերմային քայքայում և սիլիկատների գոյացում։ Սիլիկատագոյացման գործնթացը ավարտվում է 1100—1200 °С. Ապակեգոյացում Ապակեգոյացման փուլում բովախառնուրդի մնացորդները լուծվում են, իսկ փրփուրը հեռանում է, հալվածքը դառնում է թափանցիկ։ Փուլը ընթանում է 1150- 1200 С ջարմաստիճանի տակ։
- Լուսավորում Լուսավորման փուլում 1500- 1600 °С ջերմաստիճանի տակ նվազում է ապակեզանգվածի գազերով գերհագեցումը։ Ինչի հետևանքով մեծ պղպջակները բարձրանում են ապակեզանգվածի մակերևույթի վրա, իսկ փոքրերը լուծվում։ Փուլի արագացման համար բովազանգվածի մեջ ներարկվում են լուսավորիչներ։ Համասեռացում Լուսավորման հետ միաժամանակ ընթանում է հոմոգենեզացիան- ապակեզանգվածի բաղադրության համասեռացումը։
- Ձուլման վերջին փուլում՝ ապակեզանգվածի սառեցման ժամանակ գլխավոր պահանջը, դա ջերմաստիճանի անընդհատ նվազումն է, առանց բաղադրության փոփոխության։ Գործնթացի խանգառման դեպքում առաջանում են փոքր պղպջակներ։
- Ապակեզանգվածից իրերի ձևավորումը կատարվում է մեխանիկական ճանապարհով ապակեձևավորող մեքենաների վրա։Ապակու ձևավորումից հետո, այն ենթարկվում է ջերմային մշակման։
- Ձուլման ընթացքում քիմիական ռեակցիաներից ամենակարևորը սիլիատների առաջացման գործնթացներն են։Նրանք ավարտվում են նատրումի և կալցիումի սիլիկատների, ինչպես նաև բարդ սիլիկատների առաջացմամբ։ CaNa2(CO3)+SiO2=CaSiO3+ Na2SiO3+2CO2 CaCO3+ SiO2 =CaSiO3 + CO2 Na2 CO3 + SiO2 = Na2SiO3+ CO2
- Մետաղական ապակի. Դա ապակի է մետաղական հատկություններով։Այն կարելի է դարբնել և ձուլույթներ պատրաստել։ Կարծրությամբ այն գերազանցում է կապարը, սակայն երեք անգամ ավելի թեթև է և առավել էժան։
- <<Տեխնիկական>> ապակիների նորագույն տեսականերն են հանդիսանում լազերային,ֆոտոքրոմային, կիսահաղորդիչ,օպտիկական,մագն իսաակտիվ և այլն։
- «Սիլիցիումի կիրառումը ռադիոէլեկտրոնիկայում»
Վերջին տասնամյակում կիսահաղորդչային էլեկտրոնիկայի բնագավառի և՛ տեսաբան և՛ փորձարար հետազոտողների ուշադրության կենտրոնում է
գտնվում SiC-ը որպես՝ 21-րդ դարի հեռանկարային նյութ, ինչպես ուժային, այնպես էլ
բարձրհաճախականային ու բարձրջերմաստիճանային էլեկտրոնիկայի բնագավառների
համար [1,2]: Այս նյութի տարբեր այլափոխությունների վրա ձևավորված մեծ թվով
կիահաղորդչային, այդ թվում նաև Շոտկիի արգելքով կառավարվող և մետաղ-մեկուսիչ-
կիսահաղորդիչ կառուցվածքներով տրանզիստորների ստացումն ու բնութագրերի
հետազոտումը գտնվում են նախնական ուսումնասիրման փուլում և կարիք ունեն
հետագա տեսական և փորձնական հետազոտությունների:
SiC-ային կիսահաղորդչային տարբեր սարքերին նվիրված գիտական գրականության մեջ
ներկայումս հայտնի բոլոր քննարկումներում ընդունվում է, որ հարստացնող
խառնուրդներն առաջացնում են ծանծաղ մակարդակներ և սենյակային
ջերմաստիճաններում լրիվ իոնացված են: Մյուս կողմից, հետազոտություններում
բոլորովին հաշվի չի առնվում հատկապես լայն արգելման գոտիով (ինչպիսին SiC-ն է)
կիսահաղորդիչներին հատուկ մի հանգամանք, այն է` արգելման գոտում
անխուսափելիոեն գոյություն ունեցող կպչուն և թակարդային մակարդակների
առկայությունը:



















 (ֆոսֆոնիումի քլորիդ)
(ֆոսֆոնիումի քլորիդ)